PROTACは標的タンパクのバインダーとE3リガーゼのバインダー(デグロン)をリンカーで繋げた構造をしており、標的タンパクとE3リガーゼを物理的に近づけることで分解誘導を行っています。こう聞くとイメージ的にはPROTACによって近い距離にゆるく標的タンパクとE3リガーゼが引き寄せられてから反応が進行するように感じますが、実は標的タンパク-PROTAC-E3リガーゼは比較的強固な3者複合体(ternary complex)を形成していて、この複合体の安定性が分解誘導活性に重要であることが一連の研究で解明されています(論文1, 2)。PROTACにおいては標的タンパクとバインダーの結合親和性と分解誘導活性にはあまり相関がないことが知られていますが、これは複合体の安定化作用(すなわちE3リガーゼと標的タンパクのPPI)によって説明できます。最近ではこのternary complexの安定性を指標とした合成展開も実施されています。またこの3者複合体は細胞内でも形成されていることが、Fluoppiを用いた手法で観測されています(論文3)。
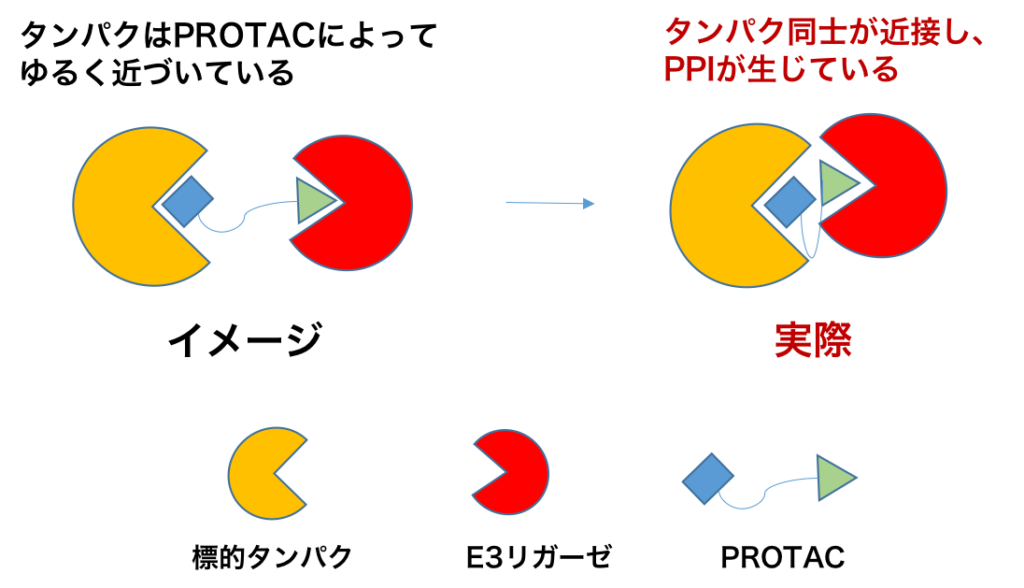
上記のternary complex研究を行ったDundee大Chulliらのグループはこの構造に着目し、よりternary complexを取りやすいようにPROTACを固定化すれば分解誘導活性が高まるという仮説からPROTACのマクロサイクル化研究を実施しました(論文4)。メドケムでよく行われる環化による活性コンフォメーションの固定ですね。
既知のBRD4分解誘導剤であるMZ1とBRD4-BD2の結晶構造を参考に適切な位置に二つ目のリンカーを導入してマクロサイクル化した化合物は、BRD4-BD2への結合親和性自体は10倍以上低下したものの、ternary complexの安定性および分解誘導活性はMZ1と同等でした。この結果から、ternary complexの安定性を指標にした合成展開の重要性と、PROTACのデザインとしてマクロサイクル化が有効であることが示されました。今回の研究では化合物としての本質的な改善は見られませんでしたが、マクロサイクル化による膜透過性の向上なども期待できるので、合成展開の方向性の一つとして頭に入れておくと良いのではないでしょうか。





コメントを残す