前回のエントリでご説明した通り、過去の承認薬・製薬業界を振り返ることで未来の戦略設定のヒントを得ようということで、今回から年度ごとに振り返りたいと思います。ちなみに前回、Nature review drug discoveryの企画は2007年が最初と記載したのですが、違う名前で2007年以前も実施されているようでした。今回の企画については、予定通り2007年からスタートにいたします(論文)。
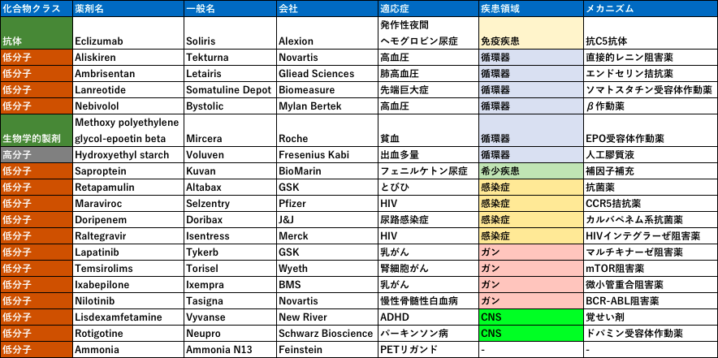
下記に2007年のFDA承認薬をリストアップしています。まず一目見て、少ない!という印象ですよね。1996年が56剤、2019年が48剤なのでこの年の18剤は極めて少ないです。19剤は1983年の記録スタート以来最低の承認数のようです。これは、前年にあったrosiglitazoneの心障害リスク事件などに由来する、FDAの安全性プロファイルの厳格化が影響しています。この傾向を受けての著者らは、「治療薬が無いような疾患・症状であれば、安全性リスクの許容性は上がるはず。すなわち希少疾患などスペシャリティー領域を志向するトレンドはより強くなっていく」「感染症やガン領域もリスクを受け入れやすいため承認されやすく、それは本年度の承認リストにも反映されている」
とコメントしています。最近はバイオベンチャー由来の希少疾患薬・抗がん剤の承認が増えている印象ですが、こういった10年前からのトレンドを踏襲した結果なのかなと感じました。
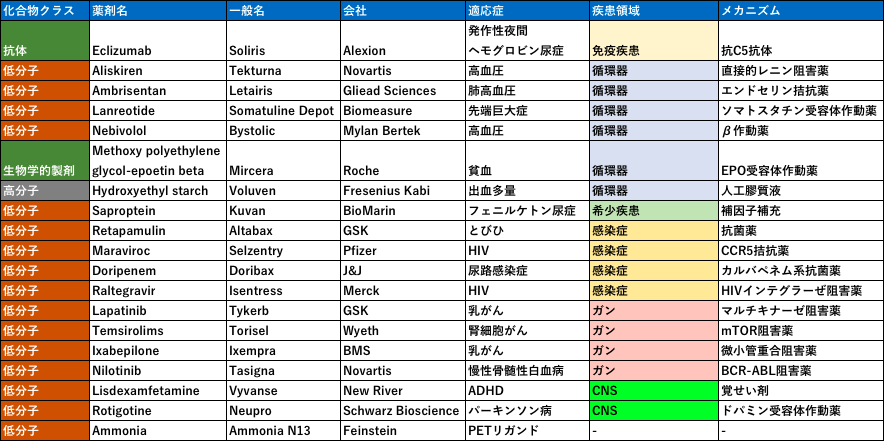
またこのRosiglitazoneの影響を受けて多くの承認案件がずれ込んだなかで、バイオベンチャーはより強い影響を受けたそうです。これは当局との連携や制度に対する理解度により生まれていることから、バイオベンチャーとファーマの連携がもっと進めば効率的な創薬ができるとコメントされています。このトレンドも現在につながっていますね。
そして個人的な感想ですが、まだまだ慢性疾患を標的とした循環器系の創薬が多く、一時代前のラインナップの印象です。この後アンメットニーズの減少した循環器領域創薬は停滞し、製薬会社のフォーカスはガンに移っていきます。ブロックバスターモデルを支えた一大領域の終焉は、製薬会社にとって変革を強要されるイベントでした。先にも記しましたが、ガンは安全性の面でリスクを取りやすいので新規技術との親和性も高く現在の創薬トレンドにマッチしています。この2000年代後半が、ガン領域にチャレンジする最後のチャンスだったかもしれません。第一三共のように、ここでガンに舵取りできた会社はうまく波にのっています。2020年の創薬におけるラストチャンスの疾患領域には何でしょうか?
モダリティ(なんて言葉はなかったと思いますが)の観点でいえば、ほとんど低分子ですね。ただ創薬の現場においては、この頃は先発の抗体医薬の成功を受けて抗体医薬万歳!の流れだったと思います。そして日本の製薬メーカーはその流れに乗り遅れたとして反省し始めた頃ですかね。この後の年度では抗体がどんどん増えていきます。
この風潮は今の遺伝子治療・核酸に似ていますが、結局抗体もすべての標的にアプローチできるわけでは無かったので、遺伝子治療・核酸も同じ流れになると思います。バイオロジクスは標的設定からの物取りスピードの速さが魅力でみんな飛びつくのですが、裏を返せば魅力的な標的はすぐに消滅してしますのでよく考えなくてはなりません。そして抗体がすべてを制圧できなかったのと同様の理由で新規モダリティにも限界があります。それはデリバリーです。DDS研究はいろいろありますが、先を走ってきた抗体が依然として脳に入っていないことを考えると、実現まではまだまだと考えるのが自然です。まあこの辺は別のエントリで書いてみたいと思っています。
ということで2007年度の振り返りでした。以降、何か見えてくるのに期待しつつ、1年ごとに振り返っていきます。





コメントを残す