Differencial PROTAC substrate specificity dictated by orientation of recruited E3 ligase Nat. Commun. 2019, 10, 131.
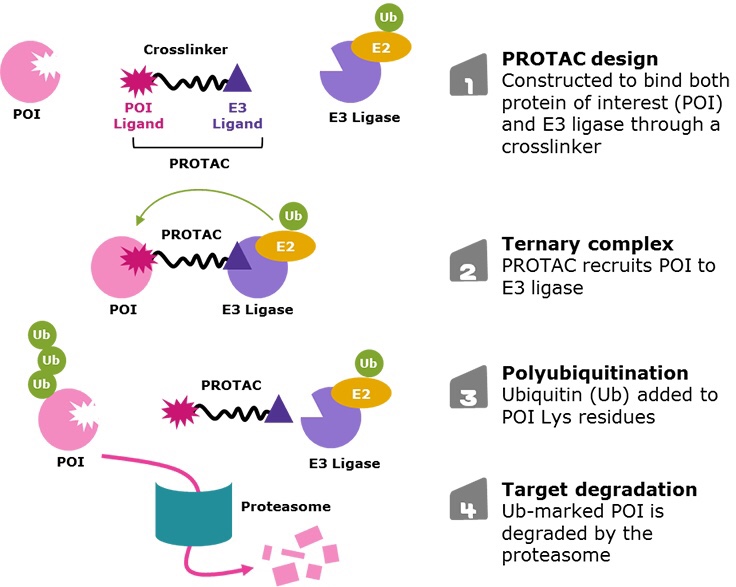
前回のエントリではternary complexの安定性が分解誘導活性に重要という説明をしました。ただし、PROTACの作用には単純なternary complex形成だけでは説明できない要素があります。今回はPROTACの始祖であるCraig M. Crewらによる、「同じwarhead(標的タンパクバインダー)と同じE3リクルーターを使ったのにリンカー位置だけでサブタイプ選択性が大きく変化した」報告を紹介します。
warheadとE3リガーゼの相性に関する知見は以前から報告されていました。たとえばCrew教授らはBCR-Abl degraderの研究(論文)において、dasatinibをwarheadとした場合、CRBNではBCR-Ablとc-Ablをともに分解しましたが、VHLではc-Ablのみの分解でした。一方で、bosatinibをwarheadとしてVHLを用いた場合にはいずれも分解できませんでした。これらは、warheadおよびE3リガーゼ単体の性質では全く説明できない現象です。
また今回紹介する文献にも使われているforetinib(c-Met阻害剤)ベースのPROTACにおいても、以前の報告(論文)で foretinib単体は>130のキナーゼを阻害するものの、VHLとのPROTACはわずか10未満のキナーゼしか分解誘導しないことを報告しています。Crew教授らはこの論文でternary complexの重要性を訴えています。
以上の経験から、彼らは同じwarheadとE3リクルーターを用いても、結合様式の違いで標的指向性を変えられるのでは無いかと着想しました。先のforetinibは最終的にp38α MAPKのdegraderとしてworkしたのですが、p38 MAPKにはα〜δの4種類のサブタイプが知られています。一般的なキナーゼと同様に、阻害剤でこのサブタイプ選択性を発現するのは容易ではありません。そこで結合様式を変化させてp38αおよびp38δ二種類の選択性が出せるか、またサブタイプ選択性が何に由来するかを検証しました。
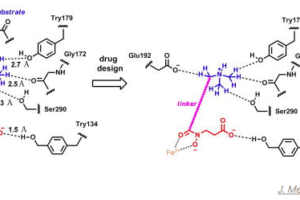
種々リンカー位置検討の結果、アミドタイプとよばれるVHLの末端アミドからwarheadを結合させたPROTAC(SJFα)はp38αを分解しました。一方で、フェニルタイプと呼ばれるVHLの中心のベンゼン環から分岐させてwarheadと結合させたPROTAC(SJFδ)はp38δ選択的に分解誘導しました。分解誘導作用はプロテアソーム阻害剤によりキャンセルされました。
これらの分解誘導選択性がternary complex形成に由来しているか調べるため、各PROTACとp38α、δおよびVHLのternary complex形成を確認しました。その結果、期待通りp38αについてはSJFαとはternary complexを形成し、SJFδとは形成しませんでした。しかしながら、残念な事にp38δはSJFα、SJFδ両方とternary complexを形成しており、ternary complexの形成の有無だけでは、分解誘導活性を説明できないことがわかりました。
その後細胞内TmアッセイやSPRなど詳細な解析から、SJFδの方がよりp38δと安定な複合体を形成していることがわかったのですが、シンプルな結合評価だけはミスリードがあることを示しています。論文にもあるように、ternary complexの形成は分解誘導の必要条件であるのはまちがい無いのですが、十分条件ではありません。これは現状、ternary complexの結合親和性を指標に合成展開をするのはリスクがあるということを示しており、具体的にternary complexの要素をどう実際のタスクに反映させていくかについては工夫が必要になりそうです。






コメントを残す