エピジェネティクスは重要な創薬標的の一つで、定義は人によって少しずつ違うかも知れませんが大体「DNA塩基配列の変化を伴わない後天的遺伝子発現制御機構」というニュアンスで理解されています。従来のタンパク質制御と異なり遺伝子制御が可能になるため、全く新しい治療アプローチにつながると期待されました。これらは主にDNAメチル化およびヒストンの修飾により制御されており、メチル化酵素やヒストンアセチル化酵素の調節薬が創薬標的になりうるということです。
エピジェネティクスはwriter, eraser, readerの三種類のたんぱく質によって制御されており、DNAで言えばメチル化酵素DNMTがwriter、脱メチル化酵素TETがeraser、MeCP2などのMBDがreaderになります。writerは不活化、eraserは活性化、readerはwriterによって不活化された状態を読み取ってシグナルに変換する役割を果たしています。DNAのメチル化はシトシンの5位で起き、5mCが生じます。シトシン5位は炭素なので、メチル化はC-C結合形成になります。なので脱メチル化には少し煩雑なステップが必要で、三度酸化されてカルボン酸になったのちに脱炭酸酵素によってトータルで脱メチル化が達成されます。
DNAのメチル化は主にプロモーター領域にあるCpGアイランドと呼ばれる配列で起きています。この領域のCがwriterによってメチル化されると、readerに認識されて抑制シグナルが流れ転写が抑えられるのです。
これがどう創薬に繋がるかと言うと、例えばガンではガン抑制遺伝子のCpGアイランドが過剰メチル化されて不活化されています。DNMTの阻害剤であるアザシチジンを作用させると抑制遺伝子が活性化し、ガン化が抑えられるのです。アザシチジンは骨髄異形成症候群を適応に承認されています。
癌の他にも、例えば希少疾患である脆弱性X症候群(Fragile X Syndrome)では変異により過剰メチル化がおきてFMR1遺伝子が不活化されることが疾患原因になっています。
なのでこう言った疾患への広がりも考えられるのですが、DNAメチル化調節創薬には毒性という大きな問題点があります。おそらく全ての遺伝子はメチル化制御を受けているはずですが、writerであるメチル化酵素の種類は限られています。よって莫大な数の遺伝子がアザシチジンなどの阻害剤によって変動してしまうのです。これは強い副作用に繋がってしまいます。ガン治療ではある程度の副作用は許容されますが、その他の疾患では厳しいです。
ということでまずはDNAメチル化による遺伝子制御について書いてみましたが、DNAメチル化は次に出てくるヒストン修飾に比べてプレーヤーの数が少ないのでガン以外への広がりはより厳しいと思います(間違ってたらスミマセン)。エピジェネ全体に言える事ではあるのですが、遺伝子選択性に繋がる技術的ブレークスルーが期待されます。


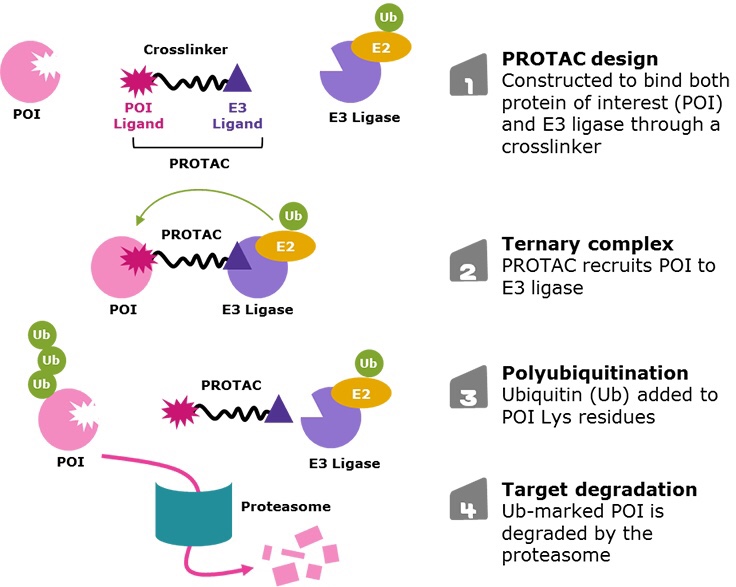



コメントを残す