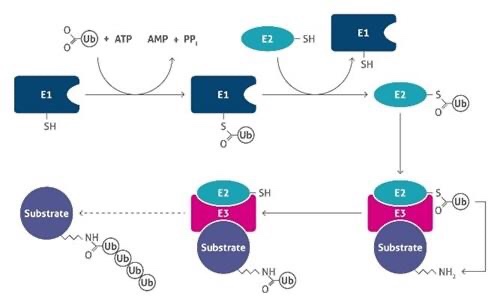
ケミカルノックダウンは新規モダリティーの一種です。ノックダウンといえばsiRNAを使った遺伝子ノックダウンがもっとも一般的です。一方で化学合成した中分子を用い、タンパク質のノックダウンを実現する手法の事をケミカルノックダウンと呼んでいます(大体こんな感じの定義と思います…ただsiRNAも化学合成だし、”ケミカル”の基準は不明)。最近はケミカルノックダウンよりも、用いられている化合物の総称であるPROTAC (PROteolysis TArgeting Chimera)がよく使われていますね。
このモダリティー(というか新規モダリティー全般)は非常に創薬ストラテジーがシンプルです。病態で異常に上昇し悪さをしているタンパク質を、生体の分解系であるユビキチン-プロテアソーム系の力を借りて分解するというものです。従来の阻害剤などは機能を止めるだけなので薬剤がなくなると効果が消失する一方、PROTACは分解してしまうため、再度タンパク質が合成されるまで効果が持続しより高い薬効が望めます。
タカラバイオHPより
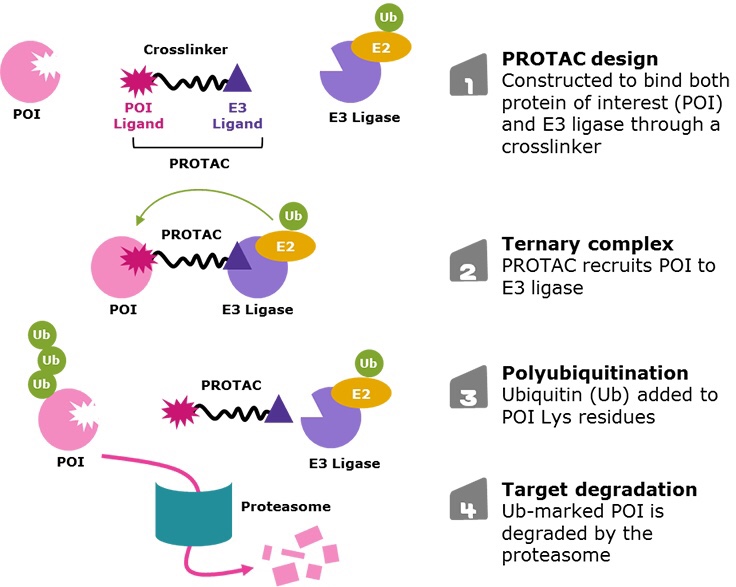
化合物のデザインもシンプルで、標的タンパクのバインダーとE3リガーゼのバインダーをリンカーで結合して標的タンパク質とE3リガーゼを近づけるというものです。くっついたまま薬効を示すのでcleavableなリンカーにする必要も無く、検討するのはリンカーの長さとバインダー結合位置くらいで、そこで活性と全体の物性を調節するイメージです。なので、適切な標的であれば化合物取得スピードは早いと思います。
Sigma-Aldrich社HPより
この技術のトップランナーはArvinasという会社で、先日それぞれエストロゲン受容体およびアンドロゲン受容体を標的とした2本のPhase 1の結果を公表し、忍容性に問題のないことを報告しました。http://ir.arvinas.com/news-releases/news-release-details/arvinas-presents-platform-update-including-initial-data-first
またArvinasは中枢に移行するPROTACの開発にも成功し世間を驚かせました。ADの原因とされる繊維化タウの分解薬ということでこちらも期待される薬剤です。PROTACという技術を抗癌治療医以外に広げられること、それも中枢疾患にまでアプローチできる可能性があるという点で、非常にインパクトのあるデータだと思います。神経変性疾患にはタンパク質の異常凝集が原因とされているものが多いため、凝集体を分解できる本手法との親和性は高いと考えられます。http://ir.arvinas.com/news-releases/news-release-details/arvinas-present-preclinical-tau-directed-protacr-protein
このPROTACですが、当然全てのものに適応できる訳ではなく、私の認識では3つの課題があります。一つは分子量が大きいため細胞膜透過性が低く、血中から標的に移行して作用を示すためには高い投与量が必要なことです。標的が血中や血管内皮、もしくは内皮が破綻しているガン細胞であれば良いのですが、神経などに到達するためにはもう一工夫必要と思われます。
2つめの課題は、生体内の機能を借りているため、標的との相性があるということです。PROTACと結合した標的タンパク質は、リクルートされたE3リガーゼによってリシン残基がユビキチン化され、プロテアソームにより分解されます。つまり適切な位置にリシン残基が無いとこのメカニズムはうまく働かず、せっかく標的タンパク質とE3を近づけても分解誘導されないという事態も起こるのです。標的タンパク質のポケットの近くにリシンがあるかくらいは確認できるのですが、それが実際に役に立つかはやってみないとわかりません。まあやってみればいいのですが、悪いタンパク質を何でもPROTACで壊せば治療できる!とはならないのです。
3つ目の課題は、機能性ポケットの無いUndruggableなターゲットにアクセス出来るとはいえ、少なくとも何かしらのポケットは必要という点です。ある程度の親和性を得られるポケットが無いとバインダーが取得できません。そしてこの点のもう一つ重要なこととして、バインダーの報告がない標的の場合バインダー取得から始めなくてはなりません。当然バインダーには選択性が求められますので、新規バインダーの取得となると低分子創薬1テーマくらいの労力は必要でしょう。既存のPROTACも既知のバインダーを利用したものばかりですので、Arvinasの掲げる”Undruggable to druggable”まではまだギャップがあるかな、という印象です。
アンチセンス核酸やsiRNAなどの遺伝子ノックダウンは配列さえあればどんな標的でも対象にできるので、新規モダリティー=万能という感覚になりがちなのですが、決してそうではなくそれぞれにPros-Consがあることを認識することが重要だと思います。核酸医薬にもデリバリーという大きな課題がありますし、狙った疾患に対してどのモダリティーが最適かを判断できるために個々をよく理解することが今後求められると思います。





コメントを残す