前回まで複数回にわたってPROTAC関連について紹介してきました。非常に可能性を秘めた技術であり、Arvinas社を盟主として創薬業界をしばらく席巻していくと思われます。
ところで、PROTAC研究の契機となったのはかつて極めて重篤な薬害を引き起こし、その後抗がん剤として再評価されたサリドマイドの作用機序解明研究でした。1957年に睡眠薬として発売後、胎児への強い催奇形性から重大な社会問題を引き起こしたのち、2006年に米国で多発性骨髄腫の治療薬として再承認を受けた本薬剤は、長らくの間その作用機序が不明でした。ところが2010年、東工大のグループによりサリドマイドがセレブロン(CRBN)というユビキチンリガーゼの構成タンパクに強く結合することを見いだし、このタンパクが催奇形性の原因となっていることが証明されました。(文献)
さらに後続研究によって、サリドマイドの誘導体であるレナリドマイドは免疫系に重要な役割を担うイカロス(IKZF1)およびアイオロス(IKZF3)という転写因子を分解していることがわかりました(文献)。すなわちサリドマイド誘導体は、分解する側(CRBN)とされる側(IKZF1/3)をくっつける糊(glue)のような働きをしていたのです。
あの小さなサリドマイド誘導体が二つのタンパク質に同時に結合するとは分子デザイン的にはなかなか考えられないです。こういうすごい機能を持った分子が取れてくるのが、かつては当たり前に実施されていたフェノタイプスクリーニングの凄さですよね。
ではこの奇跡はサリドマイドだけかというとそうでもなくて、エーザイ社によって開発されていたスルホンアミド誘導体indisulamも似たような分子糊の機能を有していることが報告されました(文献)。この分子もサリドマイドと似たような機能を有していて、ユビキチンリガーゼの構成因子であるDCAF15とスプライシング因子であるCAPERαをくっつけています。最近、このindisulamとDCAF15、CAPERα(別名RBM39)、および足場タンパク質の4者複合体の結晶構造が報告されました(文献)。
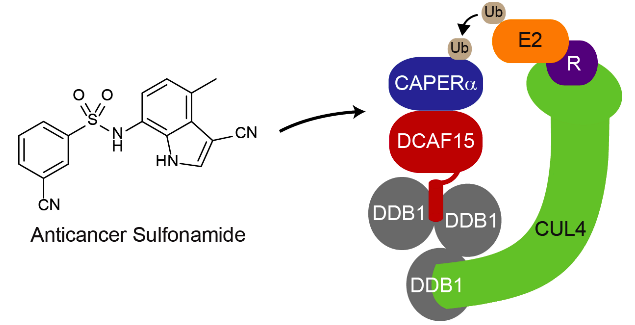
このように、PROTACはサリドマイドの機能解明から始まっているのですが、そもそもサリドマイド自体がタンパク質分解誘導機能を持ったスーパー分子だったのです。PROTACは他の標的タンパク質に対するサリドマイド様分子を効率的に見つけるために編み出された手法であり、ある意味分子デザイン的にはレベルを下げて汎用性を上げているイメージです。
実はサリドマイドとindisulamには一つ大きな違いがあります。それはサリドマイドが単体でCRBNおよびIKZFsと結合する一方で、indisulamは両者が揃って初めて結合するという点です。これはindisulamはPROTACのバインダーにならないこと、およびindisulamの様な化合物ヒットを取得するまたは最適化する場合、必ず両者の揃った系を用いる必要があるということを意味します。さらに以前の稿でもお話しした通り、複合体をうまく形成したとしてもそれが分解誘導につながるかはやってみないと分かりません。
何が言いたいかというと、シンプルな系に落とし込めないのならばそもそもサリドマイドやindisulamが見出されたようなフェノタイプスクリーニングの方がいい気がするのです。そこで得られた化合物が結果的にmolecular glueかも知れませんが、このコンセプトを理解したからと言って創薬効率は変わらない気がしています。
いきなり低分子molecular glueを取りに行くよりは、まずはPROTAC中分子を取得したのち、それを低分子化するのが現実的にあり得る取りすすめなのかなという感想でした。





コメントを残す