前回に引き続きPROTACのフォロワーについて紹介します。ただ今回は少し趣向が異なっており、分解するものがRNAになっています。ribonucleotideを分解するのでその名もRIBOTACです(論文)。
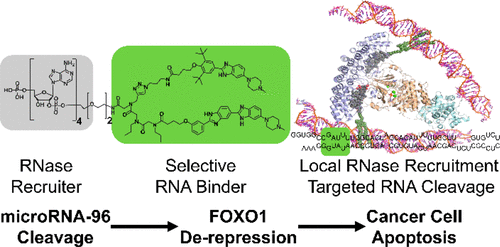
着想としては、RNAに特異的に結合するバインダーとRNAを分解する酵素RNaseに結合するバインダーをリンカーで結合させると、特定のRNAのみがRNaseにより分解されるという仕組みです。
言われてみると当たり前の着想ですが、これを実現するにはかなり高い壁があります。一つ目の壁は、RNA特異的なバインダーというものは(相補鎖核酸を除き)ほとんど無いということです。RNA結合低分子は以前から知られているものの、結合親和性の低さ、またタンパク質と比較した際のRNAの構成要素の少なさ(4種類)に由来する選択性の低さから実用レベルのものは皆無に等しいです。そして二つ目の壁は、E3リガーゼはE2結合サイトと触媒サイトの二つのポケットがあるためE2結合サイトで引き寄せてから反応させることが可能ですが、RNaseには触媒サイトしかないので、「何かで引き寄せる」ためには自分たちでアロステリックサイトを見つけ出す必要があります。
今回の報告は、この二つの壁をうまく解決しています。一つ目の課題に対しては、詳細は省きますがRNAバインダー研究の大家であるDisney研がすでに報告している低分子dimer化を活用したmiRNA特異的バインダーの技術を利用することで解決しています。
二つ目の課題については、RNase Lという特殊なRNaseを選択することでクリアしました。RNase Lはウイルス感染に対抗する役割を持つ酵素で、普段はあまり発現していないのですが、免疫応答時には発現が上昇します。この酵素の面白いところは、dimerになった時に初めて活性を示すことです。そしてdimer化するためには2′-5’のpoly(A)が必要であり、このオリゴ核酸が糊となってdimer化がおきRNase Lは活性を持ちます。この2′-5′ Poly(A)も同様に免疫応答時に産生されるようです。すなわち、2′-5′ Poly(A)はRNase Lのリクルーターとして機能することができるのです。RNase Lの性質をうまく利用するアイディアが素晴らしいですね。
ということで、2′-5′ tetraadenylate と著者らのmiRNAバインダーをリンカーで結んだRIBOTACは、めでたくmiRNA-96を特異的に分解することに成功しました。薬効としては 200 nMで50%減、またがん細胞においてmiRNA-96の下流にある抗がん作用のあるFOXO-1の発現を2倍ほど上昇させることができました。この結果は、RIBOTACという新しい概念が実現可能であることを示したマイルストン的な成果であると思います。
ただし、創薬を考えるとまだまだ課題があります。一つは、とても低分子とは言えず、特に動態面に大きな課題が想定されるという点です。オリゴ核酸と中分子のコンジュゲートなので、PROTACとアンチセンス核酸の中間くらいの性質でしょう。現状薬効がアンチセンス核酸と比べて圧倒的に低いので、まだまだブレークスルーが必要です。
そしてもっとも気になる点は、作用のメカニズムが極めてアンチセンス核酸と似ていることです。標的配列を認識してRNaseをリクルート、というところは全く同じです。リクルートしてくるRNaseがHか、Lかの違いがあるのて、その辺りで色が異なってくれば良いのですが。
あとはRNase Lは定常時の発現が少ないようなので、適用可能な病態が限定される可能性はあります。疾患検討する際にはそういった点にも注意が必要ですね。
ということで、まだまだいくつか課題はあるものの、興味深い技術であることは間違いないです。次回は、ここから少し進化したRIBOTACについて紹介します。
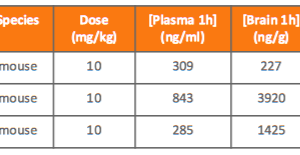





コメントを残す