前回の記事に引き続き、エピジェネティクスについて紹介していきます。今回はヒストン修飾について説明してみます。
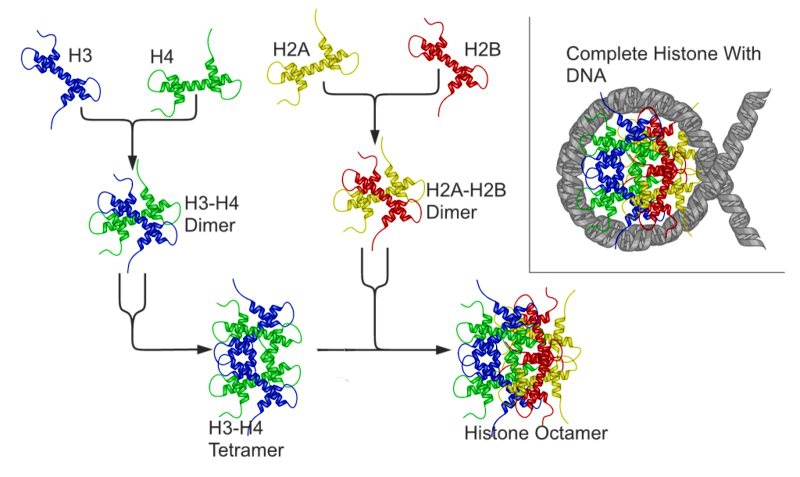
ヒストンはH1, H2A, H2B, H3, H4の5種類が知られており、H2A~H4までの4種類が2個づつ集まり8量体を形成し、ここにDNAが巻きついてヌクレオソームという複合体を形成します。ヒストンは塩基性アミノ酸(リシン・アルギニン)を豊富に含んで塩基性を呈しており、これがDNAのリン酸と相互作用することで強固な結合を形成します。DNAが転写される際にはヌクレオソームの乖離が必要となるため、ヒストンの修飾による物性の変化は転写調節スイッチとして重要な役割を担っています。
この物性スイッチにはメジャーなものとして二種類が知られています(その他にもリン酸化などマイナーなものは幾つかあります)。一つ目はリジンのメチル化です。メチル化により塩基性が増強されるため、ヒストンとDNAの相互作用は強固になり、転写が不活化されます。よってメチル化は転写にとって負のスイッチとなります。
前回もお話しした通りエピジェネティクスはwriter、reader、eraserの三種類の要素により制御されており、このメチル化も例外ではありません。
WriterはDNAメチル化酵素であり、PRMT, EZH, NSDなどが知られています。これらには複数のサブタイプが知られており、どのヒストンのどのリジンをメチル化するか(ある程度)制御されています。遺伝子によって転写制御に重要なリジン位置が異なっているので、メチル化酵素は下流の転写制御遺伝子にある程度分担があることになります。これは創薬標的の観点からは重要で、酵素選択性によりある程度の遺伝子選択性が期待できるため、毒性と薬効の乖離が望めるのです。この中ではEpizyme社のEZH2阻害剤Tazemetostatが類上皮肉腫を適用疾患として上市されており、また他社からも第一三共のDS-3201など後続品が開発されています。
メチル化のreaderタンパクについては、よく知られているのはHP1というタンパクです。HP1はクロモドメインと呼ばれる認識ドメインでメチル化リシンを認識し、その後HP1が多量化する事で転写不活化を誘導します。ただ創薬標的としてはあまり注目を集めていないのではないのでしょうか。
少し長くなってきたので、次回に続きます。





コメントを残す